Teisipäev, 17. september 2013 - Shanghai Meditsiiniliste Asutuste Instituudi ja Scrippsi uurimisinstituudi teadlased on võimalikult täpselt määratlenud HIV-eelistatud luku inimese keha immuunsussüsteemi rakkudesse sisenemiseks. See on korretseptor CCR5, mida leidub kaitsvate rakkude või lümfotsüütide pinnal. See pole ainus HIVi sisenemise tee, vaid üks olulisemaid.
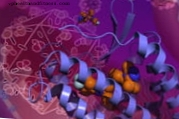
Inimese immuunpuudulikkuse viirus (HIV) vajab CD4-retseptorit, et nakatada organismi erinevaid lümfotsüüte, kuid see peab toimima ka koostoimega kahest ka raku pinnal esinevast kaasretseptorist: CCR5 või CXCR4. Hiina ja Ameerika teadlastel on õnnestunud teha esimesest täiuslik foto, lisades selle sellele, mida nad juba olid teinud teistest saajatest.
Ideaalne foto pole midagi muud kui kristalli nimetatava korretseptori kõrge eraldusvõimega aatomistruktuur - asi, mida on mikrobioloogia riikliku keskuse molekulaarpatoloogia valdkonna juhi José Alcamí sõnul väga raske saavutada. seda tüüpi molekulid, mis õigustab selle avastuse avaldamist mainekas ajakirjas Science.
Selle eksperdi selgitusel kasutab nakkuse alguses 100% HIV-ist raku sisenemiseks CCR5 korrektorit, kuid kogu nakkuse ajal vahetavad viirused umbes 40% -l patsientidest teist korrektor, CXCR4. Sel ajal muudavad viirused oma perekonnanime ja lähevad nimeks “tropism R5” viirusteks “tropism X4”. Võrrandi edasiseks komplitseerimiseks sisenevad mõned viirused - troopika R5X4 - samaaegselt kahe saidi kaudu.
"See on kahe lukuga uks; seetõttu võib viirus teise luku abil ukse avada, kui üks neist on mõne ravimiga blokeeritud, " ütleb Alcamí. See farmakoloogiline blokeerimine on saavutatud ainult üks kord ja ainult CCR5 korral tänu ravimile Maraviroc, mida kasutatakse täna seropositiivsetes ravimites, kui mõni esimese raviskeemi jaoks ette nähtud kombinatsioon ei toimi.
Ajakirjas Science avaldatud avastuse olulisim tagajärg on see, et CCR5 kristallograafilisest struktuurist saab välja töötada uued sellele sihtmärgile mõjuvad ravimid, vältides sellega HIV sisenemist selle kaasretseptori kaudu. Seda ideed mõjutab täpselt artiklile lisatud juhtkiri, mille on kirjutanud Cornelli ülikooli teadur Per Johan Klasse. Autor juhib tähelepanu sellele, et selle eesmärk ei ole mitte ainult CCR5 vastaste uute ravimite tootmine, vaid ka teadmiste parandamine viiruse koostoime kohta rakkude teiste osadega, näiteks ümbrisega.
"Narkootikume saab konstrueerida kõigepealt arvutis ja seejärel reaalsel viisil, mis vastab täpselt äsja määratletud struktuurile, " räägib Alcamí. Kuid lisaks võib see leid hüpoteetiliselt viia seropositiivsete patsientide elukvaliteedi olulisele paranemisele. "Praegu on meil juba võimalus viirust tõrjuda ühe igapäevase tableti abil, kuid tulevikus võiksite mõelda teraapiale, mida manustatakse kaks või isegi üks kord nädalas, " ütles Alcamí.
Selle kaasretseptori kristallid lisatakse viiruse teistest osadest pärinevatele muudele kristallidele, näiteks selle ümbrisele või integraasile ja proteaasile. Kõik need struktuurid on viinud uute HIV-vastaste ravimite väljatöötamiseni ja võib öelda, et need on aidanud kaasa tõsiasjale, et viirus on enamikul juhtudel surmaga lõppenud, et seda ravimitega kontrollida.
Veel üks avastuse eelis on see, et "see aitab mõista, miks on viirusi, kes eelistavad välisukse avamiseks ühte või teist lukku, " selgitab CNM-i spetsialist.
Uuringu autorid olid seda molekulaarfotot püüdnud teha kuus aastat, kuna Materia Medica juhtiv autor Beili Wu valis Scrippsi uurimisinstituudi oma järeldoktoriõppeks HIV-kaasretseptorite alal, kus ta koolitas Raymond Stevensi laboris, veel üks autoritest. "Nüüd, kui meil on kahe kaasretseptori kolmemõõtmelised struktuurid, on väga tõenäoline, et näeme uue põlvkonna HIV-vastaseid ravimeetodeid, " ütles viimane pressiteates.
Selle kvaliteetse foto saamiseks kasutasid teadlased täpselt ravimit, mis blokeerib korretseptori sissepääsu, kuna see "stabiliseerib CCR5 ühes asendis", selgitab Alcamí.
Hispaania teadlane on tuttav oma Hiina ja Ameerika kolleegide tööga. Tegelikult viidatakse teaduse uurimisel kahele teosele, millest ta on kaasautor koos teise Hispaania teadlase Javier García Péreziga ja Pasteuri instituudi teadlastega. Ühes neist määratlesid nad kristalli „joonistama” asumise vahel Maracerocsi ja selle korrektori vastastikmõjud. Teises osas uuriti mõnda ravimresistentsuse aspekti, just avastuse teist potentsiaalset kasulikkust, mis ühtlasi aitab mõista, miks mõnel juhul enam nii tõhus ravim enam ei kehti.
Alcamí sõnul on praegu 26 HIV-vastast ravimit. "Ehkki 10 või 12 võib välistada, kuna need on vananenud, on meid ikkagi 14. Prioriteet pole mitte niivõrd suurema hulga ravimite saamine, vaid ennekõike molekulid, mis toimivad viirusetsükli uutele sihtmärkidele, " ütleb ta.
Ehkki maravirok on nn teise rea ravim (neid ei määrata äsja diagnoositud HIV-patsiendile), on see ravim väga oluline, kuna see on ainus praegu turustatav ravim, mis takistab viiruse sisenemist rakku, ehkki nagu Alcamí näitab, See ei peaks sekkuma viiruse likvideerimisse.
"See on võimas ravim, väga vähese toksilisuse ja väga pika elueaga, mis võimaldab unistada tulevasest terapeutilisest kombinatsioonist, mida ei pea iga päev manustama, " ütleb ta.
Ideaalses maailmas võiks see võimalik kombinatsioon koosneda kahest ravimist, mis sulgeb kahes kaasretseptoris HIV-i leviku. Esimese puhul on maravirok juba olemas, ehkki see kristall võimaldab potentsiaalselt uute ravimite väljatöötamist, mille eesmärk on blokeerida CCR5 korretseptori kasutamist HIV-i poolt. CXCR4 kaasretseptori jaoks pole aga olnud võimalik ühtegi ravimit toota, ehkki kristalli on avaldatud kolm aastat. "Kõik katsed on toksilisuse tõttu ebaõnnestunud, " võtab Alcamí kokku.
Allikas:
Silte:
Lõigatud Ja Laste Dieet-Ja Toitumise Erinev
Inimese immuunpuudulikkuse viirus (HIV) vajab CD4-retseptorit, et nakatada organismi erinevaid lümfotsüüte, kuid see peab toimima ka koostoimega kahest ka raku pinnal esinevast kaasretseptorist: CCR5 või CXCR4. Hiina ja Ameerika teadlastel on õnnestunud teha esimesest täiuslik foto, lisades selle sellele, mida nad juba olid teinud teistest saajatest.
Ideaalne foto pole midagi muud kui kristalli nimetatava korretseptori kõrge eraldusvõimega aatomistruktuur - asi, mida on mikrobioloogia riikliku keskuse molekulaarpatoloogia valdkonna juhi José Alcamí sõnul väga raske saavutada. seda tüüpi molekulid, mis õigustab selle avastuse avaldamist mainekas ajakirjas Science.
Selle eksperdi selgitusel kasutab nakkuse alguses 100% HIV-ist raku sisenemiseks CCR5 korrektorit, kuid kogu nakkuse ajal vahetavad viirused umbes 40% -l patsientidest teist korrektor, CXCR4. Sel ajal muudavad viirused oma perekonnanime ja lähevad nimeks “tropism R5” viirusteks “tropism X4”. Võrrandi edasiseks komplitseerimiseks sisenevad mõned viirused - troopika R5X4 - samaaegselt kahe saidi kaudu.
"See on kahe lukuga uks; seetõttu võib viirus teise luku abil ukse avada, kui üks neist on mõne ravimiga blokeeritud, " ütleb Alcamí. See farmakoloogiline blokeerimine on saavutatud ainult üks kord ja ainult CCR5 korral tänu ravimile Maraviroc, mida kasutatakse täna seropositiivsetes ravimites, kui mõni esimese raviskeemi jaoks ette nähtud kombinatsioon ei toimi.
Praktilised tagajärjed
Ajakirjas Science avaldatud avastuse olulisim tagajärg on see, et CCR5 kristallograafilisest struktuurist saab välja töötada uued sellele sihtmärgile mõjuvad ravimid, vältides sellega HIV sisenemist selle kaasretseptori kaudu. Seda ideed mõjutab täpselt artiklile lisatud juhtkiri, mille on kirjutanud Cornelli ülikooli teadur Per Johan Klasse. Autor juhib tähelepanu sellele, et selle eesmärk ei ole mitte ainult CCR5 vastaste uute ravimite tootmine, vaid ka teadmiste parandamine viiruse koostoime kohta rakkude teiste osadega, näiteks ümbrisega.
"Narkootikume saab konstrueerida kõigepealt arvutis ja seejärel reaalsel viisil, mis vastab täpselt äsja määratletud struktuurile, " räägib Alcamí. Kuid lisaks võib see leid hüpoteetiliselt viia seropositiivsete patsientide elukvaliteedi olulisele paranemisele. "Praegu on meil juba võimalus viirust tõrjuda ühe igapäevase tableti abil, kuid tulevikus võiksite mõelda teraapiale, mida manustatakse kaks või isegi üks kord nädalas, " ütles Alcamí.
Selle kaasretseptori kristallid lisatakse viiruse teistest osadest pärinevatele muudele kristallidele, näiteks selle ümbrisele või integraasile ja proteaasile. Kõik need struktuurid on viinud uute HIV-vastaste ravimite väljatöötamiseni ja võib öelda, et need on aidanud kaasa tõsiasjale, et viirus on enamikul juhtudel surmaga lõppenud, et seda ravimitega kontrollida.
Veel üks avastuse eelis on see, et "see aitab mõista, miks on viirusi, kes eelistavad välisukse avamiseks ühte või teist lukku, " selgitab CNM-i spetsialist.
Uuringu autorid olid seda molekulaarfotot püüdnud teha kuus aastat, kuna Materia Medica juhtiv autor Beili Wu valis Scrippsi uurimisinstituudi oma järeldoktoriõppeks HIV-kaasretseptorite alal, kus ta koolitas Raymond Stevensi laboris, veel üks autoritest. "Nüüd, kui meil on kahe kaasretseptori kolmemõõtmelised struktuurid, on väga tõenäoline, et näeme uue põlvkonna HIV-vastaseid ravimeetodeid, " ütles viimane pressiteates.
Selle kvaliteetse foto saamiseks kasutasid teadlased täpselt ravimit, mis blokeerib korretseptori sissepääsu, kuna see "stabiliseerib CCR5 ühes asendis", selgitab Alcamí.
Hispaania teadlane on tuttav oma Hiina ja Ameerika kolleegide tööga. Tegelikult viidatakse teaduse uurimisel kahele teosele, millest ta on kaasautor koos teise Hispaania teadlase Javier García Péreziga ja Pasteuri instituudi teadlastega. Ühes neist määratlesid nad kristalli „joonistama” asumise vahel Maracerocsi ja selle korrektori vastastikmõjud. Teises osas uuriti mõnda ravimresistentsuse aspekti, just avastuse teist potentsiaalset kasulikkust, mis ühtlasi aitab mõista, miks mõnel juhul enam nii tõhus ravim enam ei kehti.
Alcamí sõnul on praegu 26 HIV-vastast ravimit. "Ehkki 10 või 12 võib välistada, kuna need on vananenud, on meid ikkagi 14. Prioriteet pole mitte niivõrd suurema hulga ravimite saamine, vaid ennekõike molekulid, mis toimivad viirusetsükli uutele sihtmärkidele, " ütleb ta.
Ehkki maravirok on nn teise rea ravim (neid ei määrata äsja diagnoositud HIV-patsiendile), on see ravim väga oluline, kuna see on ainus praegu turustatav ravim, mis takistab viiruse sisenemist rakku, ehkki nagu Alcamí näitab, See ei peaks sekkuma viiruse likvideerimisse.
"See on võimas ravim, väga vähese toksilisuse ja väga pika elueaga, mis võimaldab unistada tulevasest terapeutilisest kombinatsioonist, mida ei pea iga päev manustama, " ütleb ta.
Ideaalses maailmas võiks see võimalik kombinatsioon koosneda kahest ravimist, mis sulgeb kahes kaasretseptoris HIV-i leviku. Esimese puhul on maravirok juba olemas, ehkki see kristall võimaldab potentsiaalselt uute ravimite väljatöötamist, mille eesmärk on blokeerida CCR5 korretseptori kasutamist HIV-i poolt. CXCR4 kaasretseptori jaoks pole aga olnud võimalik ühtegi ravimit toota, ehkki kristalli on avaldatud kolm aastat. "Kõik katsed on toksilisuse tõttu ebaõnnestunud, " võtab Alcamí kokku.
Allikas:




















-przyczyny-objawy-i-leczenie.jpg)